Braltus® 10 Mikrogramm Hartkapseln mit Pulver zur Inhalation

Dieses Präparat ist rezeptpflichtig. Um weitere Informationen zum Produkt zu erhalten, loggen Sie sich bitte mit Ihren Zugangsdaten im Fachkreis ein.
Downloads
Schulungsmaterial
Telefon: 0800 800 5022
GEBRAUCHSINFORMATION: INFORMATION FÜR PATIENTEN
Braltus® 10 Mikrogramm Hartkapseln mit Pulver zur Inhalation
Tiotropium
| Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn sie enthält wichtige Informationen.
|
Was in dieser Packungsbeilage steht
1. Was ist Braltus® und wofür wird es angewendet?
2. Was sollten Sie vor der Anwendung von Braltus® beachten?
3. Wie ist Braltus® anzuwenden?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist Braltus® aufzubewahren?
6. Inhalt der Packung und weitere Informationen
Braltus® enthält den Wirkstoff Tiotropium. Tiotropium erleichtert Patienten mit chronisch obstruktiven Lungenerkrankungen (COPD) das Atmen. Bei chronisch obstruktiven Lungenerkrankungen (COPD) handelt es sich um dauerhafte Lungenerkrankungen, die mit Atemnot und Husten einhergehen. Der Begriff COPD umfasst die Erkrankungen chronische obstruktive Bronchitis und Emphyseme. COPD ist eine chronische Erkrankung, deshalb sollte dieses Arzneimittel täglich angewendet werden und nicht nur, wenn Atemprobleme oder andere Symptome der COPD vorhanden sind.
Braltus® ist ein lang wirkender Bronchodilatator, der die Atemwege erweitert. Dadurch wird erleichtert, dass die Luft in die Lunge ein und wieder ausströmen kann. Die regelmäßige Anwendung dieses Arzneimittels kann die bei diesen Erkrankungen auftretende Atemnot lindern und unterstützt damit die körperliche Aktivität und wird Ihnen helfen, die Auswirkungen der Erkrankung auf Ihren Alltag zu verringern. Es hilft Ihnen außerdem dabei, länger aktiv zu bleiben. Die tägliche Anwendung dieses Arzneimittels kann weiterhin das Auftreten von plötzlich auftretenden, vorübergehenden Verschlechterungen Ihrer Erkrankung, die bis zu mehreren Tagen anhalten können, verhindern. Die Wirkung dieses Arzneimittels hält 24 Stunden an, so dass es nur einmal täglich angewendet werden muss.
Dieses Arzneimittel sollte nicht als Notfallbehandlung von unerwarteter Brustenge, Husten oder plötzlichen Anfällen von Atemnot oder Giemen (keuchende Atmung) angewendet werden. Bitte wenden Sie dafür stattdessen einen schnell wirksamen Inhalator gegen Akutbeschwerden (Notfallinhalator) (z. B. Salbutamol) an. Bitte führen Sie diesen Inhalator für Akutbeschwerden immer bei sich.
Braltus® darf nicht angewendet werden,
- wenn Sie überempfindlich (allergisch) gegen Tiotropium oder den in Abschnitt 6. genannten sonstigen Bestandteil dieses Arzneimittels sind.
- wenn Sie überempfindlich (allergisch) gegen Atropin oder Abkömmlinge dieser Wirkstoffe, wie z. B. Ipratropium oder Oxitropium, sind.
- wenn Sie überempfindlich (allergisch) gegen Lactose oder andere Zuckerarten sind.
Warnhinweise und Vorsichtsmaßnahmen
Bitte sprechen Sie mit Ihrem Arzt, Apotheker oder dem medizinischen Fachpersonal, bevor Sie Braltus® anwenden:
- wenn Sie andere Arzneimittel anwenden, die Ipratropium oder Oxitropium enthalten.
- wenn Sie unter Engwinkelglaukom oder Prostatabeschwerden leiden oder Schwierigkeiten beim Wasserlassen haben.
- wenn Sie Nierenprobleme haben.
- wenn Sie in den letzten 6 Monaten einen Herzinfarkt erlitten haben, oder bei Ihnen in den letzten 12 Monaten instabile oder lebensbedrohliche Herzrhythmusstörungen oder eine schwere Herzleistungsschwäche (Herzinsuffizienz) aufgetreten ist.
Braltus® wird angewendet für die Dauerbehandlung Ihrer chronisch obstruktiven Lungenerkrankung; es sollte nicht angewendet werden, um plötzliche Anfälle von Atemnot oder Giemen (keuchende Atmung) zu behandeln.
Es können allergische Reaktionen vom Soforttyp, wie Hautausschlag, Schwellung, Juckreiz, Giemen oder Atemnot nach der Anwendung von Braltus® auftreten. Wenn dies eintritt, kontaktieren Sie bitte unverzüglich Ihren Arzt (siehe Abschnitt 4).
Inhalative Arzneimittel wie Braltus® können Brustenge, Husten, Giemen oder Atemlosigkeit (Bronchospasmus) unmittelbar nach der Inhalation auslösen. In solchen Fällen sollten Sie sofort einen schnell wirksamen Inhalator für Akutbeschwerden (z.B. Salbutamol) anwenden. Wenn diese Beschwerden auftreten, wenden Sie Braltus® nicht mehr an und kontaktieren Sie bitte unverzüglich Ihren Arzt.
Achten Sie darauf, dass das Pulver zur Inhalation nicht in die Augen gelangt, da dies zu tränenden Augen oder zur Verschlimmerung eines Engwinkelglaukoms (erhöhtem Augeninnendruck) führen kann. Augenschmerzen oder Missempfinden, verschwommenes Sehen, Augenhalos (Lichthöfe mit Farbringen um Lichtquellen) oder unwirkliches Farbempfinden in Verbindung mit geröteten Augen können Anzeichen eines akuten Glaukomanfalls sein. Diese die Augen betreffenden Symptome können von Kopfschmerzen, Übelkeit oder Erbrechen begleitet sein. Falls diese Anzeichen oder Symptome auftreten, sollten Sie die Behandlung mit diesem Arzneimittel abbrechen und sofort ärztlichen Rat, wenn möglich den Rat eines Augenarztes, einholen.
Das Arzneimittel in Ihrem Inhalator kann die normale Speichelproduktion im Mund verringern und dazu führen, dass sich Ihr Mund trocken anfühlt. Wenn dies länger anhält, kann es zu Karies führen. Deshalb ist auf eine gründliche Zahnhygiene zu achten. Spülen Sie Ihren Mund aus und putzen Sie sich regelmäßig Ihre Zähne.
Wenn Sie in den letzten 6 Monaten einen Herzinfarkt hatten, oder in den letzten 12 Monaten instabile oder lebensbedrohliche Herzrhythmusstörungen oder eine schwere Herzleistungsschwäche (Herzinsuffizienz), dann teilen Sie dies bitte Ihrem Arzt mit. Dies ist wichtig, damit Ihr Arzt entscheiden kann, ob Braltus® die richtige Behandlung für Sie ist.
Wenden Sie dieses Arzneimittel nicht häufiger als einmal täglich an (siehe Abschnitt 3).
Kinder und Jugendliche
Braltus® sollte bei Kindern und Jugendlichen unter 18 Jahren nicht angewendet werden.
Anwendung von Braltus® zusammen mit anderen Arzneimitteln
Informieren Sie Ihren Arzt oder Apotheker, wenn Sie andere Arzneimittel einnehmen, kürzlich andere Arzneimittel eingenommen haben oder beabsichtigen andere Arzneimittel einzunehmen, einschließlich aller anderen Inhalatoren oder in der Apotheke rezeptfrei erhältlichen Arzneimittel.
Informieren Sie Ihren Arzt oder Apotheker, falls Sie ähnliche Arzneimittel für Ihre Lungenerkrankung, wie etwa Ipratropium oder Oxitropium, anwenden oder bis vor kurzem angewendet haben.
Es wurden keine besonderen Nebenwirkungen beobachtet bei Anwendung dieses Arzneimittels zusammen mit anderen Arzneimitteln zur Behandlung der COPD, wie etwa Arzneimittel zum Inhalieren gegen Akutbeschwerden (z. B. Salbutamol), Methylxanthine (z. B. Theophyllin) und/oder Steroide zum Einnehmen oder zum Inhalieren (z. B. Prednisolon).
Schwangerschaft und Stillzeit
Wenn Sie schwanger sind oder stillen, oder wenn Sie vermuten, schwanger zu sein oder beabsichtigen, schwanger zu werden, fragen Sie vor der Anwendung dieses Arzneimittels Ihren Arzt oder Apotheker um Rat. Sie sollten dieses Arzneimittel nicht anwenden, außer es wird ausdrücklich von Ihrem Arzt empfohlen.
Verkehrstüchtigkeit und Fähigkeit zum Bedienen von Maschinen
Dieses Arzneimittel kann wegen des Auftretens von Schwindel, verschwommenem Sehen oder Kopfschmerzen die Fähigkeit zur aktiven Teilnahme am Straßenverkehr oder zum Bedienen von Maschinen beeinträchtigen.
Braltus® enthält Lactose.
Lactose ist eine Zuckerart, die in Milch enthalten ist. Bitte wenden Sie Braltus® daher erst nach Rücksprache mit Ihrem Arzt an, wenn Ihnen bekannt ist, dass Sie unter einer Unverträglichkeit gegenüber bestimmten Zuckern leiden. In Arzneimitteln, die Lactose enthalten, können zusätzlich Spuren von Milchprotein vorkommen, das bei Patienten mit schwerer Unverträglichkeit oder einer Allergie gegen Milchproteine Reaktionen verursachen kann. Bei bestimmungsgemäßer Anwendung von Braltus® in der empfohlenen Dosis, d. h. eine Kapsel täglich, können bis zu 18 mg Lactose-Monohydrat freigesetzt werden.
Wenden Sie dieses Arzneimittel immer genau nach Absprache mit Ihrem Arzt an. Fragen Sie bei Ihrem Arzt oder Apotheker nach, wenn Sie sich nicht sicher sind.
Die empfohlene Dosis beträgt das Inhalieren des Inhalts von einer Kapsel einmal täglich mit dem Zonda®-Inhalator. Eine Kapsel enthält die erforderliche tägliche Dosis Tiotropium (eine abgegebene Menge von 10 Mikrogramm Tiotropium). Inhalieren Sie nicht mehr als die empfohlene Dosis.
Dieses Arzneimittel sollte täglich zur gleichen Zeit inhaliert werden. Dies ist wichtig, da dieses Arzneimittel eine Wirkdauer von 24 Stunden besitzt.
Die Kapseln sind nur zur Inhalation vorgesehen, nicht zum Einnehmen.
Die Kapseln dürfen nicht eingenommen werden.
Der Zonda®-Inhalator, in den die Braltus® Kapsel eingelegt wird, durchsticht auf Knopfdruck die Kapsel und ermöglicht damit das Inhalieren des Pulvers. Die Kapseln dürfen nur mit dem Zonda®-Inhalator inhaliert werden. Verwenden Sie keinen anderen Inhalator zur Inhalation von Braltus® Kapseln.
Stellen Sie sicher, dass Sie mit dem Zonda®-Inhalator richtig umgehen können. Hinweise zur korrekten Anwendung des Zonda®-Inhalators finden Sie auf der Rückseite dieser Packungsbeilage. Denken Sie daran, diese Gebrauchsanweisung sorgfältig zu beachten. Zusätzlich befinden sich auf der Deckelinnenseite des Umkartons Abbildungen, in denen gezeigt wird, wie die Kapsel korrekt in den Inhalator eingelegt wird. Um ein Erstickungsrisiko zu vermeiden, legen Sie die Kapsel NIE direkt in das Mundstück. Bei Problemen im Umgang mit dem Zonda®-Inhalator bitten Sie Ihren Arzt, Apotheker oder das medizinische Fachpersonal, Ihnen die korrekte Anwendung zu zeigen.
Bei Bedarf können Sie das Mundstück des Zonda®-Inhalators nach der Anwendung mit einem trockenen Tuch oder Papiertuch abwischen.
Achten Sie darauf, dass Sie nicht in den Zonda®-Inhalator hineinatmen. Achten Sie bei der Anwendung von Braltus® darauf, dass das Pulver zur Inhalation nicht in die Augen gelangt. Ist Pulver zur Inhalation in die Augen gelangt, können Symptome wie verschwommenes Sehen, Augenschmerzen und/oder gerötete Augen auftreten, daher sind die Augen unverzüglich mit lauwarmem Wasser zu spülen. Holen Sie sofort ärztlichen Rat ein.
Wenn Sie den Eindruck haben, dass sich Ihre Atmung insgesamt verschlechtert, informieren Sie Ihren Arzt so bald wie möglich darüber.
Anwendung bei Kindern und Jugendlichen
Braltus® sollte bei Kindern und Jugendlichen unter 18 Jahren nicht angewendet werden.
Wenn Sie eine größere Menge von Braltus® angewendet haben, als Sie sollten
Wenn Sie den Inhalt von mehr als einer Kapsel Braltus® pro Tag inhalieren, sollten Sie umgehend mit Ihrem Arzt sprechen. Sie könnten ein höheres Risiko haben, Nebenwirkungen wie trockener Mund, Verstopfung, Beschwerden beim Wasserlassen, beschleunigter Herzschlag oder verschwommenes Sehen zu erleiden.
Wenn Sie die Anwendung von Braltus® vergessen haben
Sollten Sie die rechtzeitige Inhalation einer Dosis vergessen haben, holen Sie diese baldmöglichst nach. Sie dürfen jedoch nicht die doppelte Dosis (2 Kapseln) auf einmal oder am selben Tag inhalieren. Fahren Sie danach wie gewohnt mit der Inhalation fort. Inhalieren Sie nicht die doppelte Menge, wenn Sie die vorherige Anwendung vergessen haben.
Wenn Sie die Anwendung von Braltus® abbrechen
Bevor Sie die Anwendung von Braltus® abbrechen, sprechen Sie mit Ihrem Arzt oder Apotheker. Wenn Sie die Anwendung dieses Arzneimittels abbrechen, können die Symptome und Beschwerden der COPD zunehmen.
Wenn Sie weitere Fragen zur Anwendung dieses Arzneimittels haben, wenden Sie sich an Ihren Arzt, Apotheker oder das medizinische Fachpersonal.
Wie alle Arzneimittel kann auch dieses Arzneimittel Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
Zu den schwerwiegenden Nebenwirkungen zählen allergische Reaktionen mit Anschwellen des Gesichts oder Rachens (Angioödem) oder andere Überempfindlichkeitsreaktionen (z. B. plötzlicher Blutdruckabfall oder Schwindel) oder vermehrtes Giemen (keuchende Atmung) und Atemnot. Diese Reaktionen können entweder einzeln oder im Rahmen einer schweren allergischen Reaktion (anaphylaktische Reaktion) nach Anwendung dieses Arzneimittels auftreten. Solche schwerwiegende Nebenwirkungen sind selten. Unmittelbar nach der Inhalation kann wie bei allen inhalativen Arzneimitteln bei einigen Patienten unerwartet Brustenge, Husten, Giemen (keuchende Atmung) oder Atemnot (bekannt als Bronchospasmus) auftreten.
Informieren Sie bei solchen Nebenwirkungen sofort einen Arzt.
Wenden Sie Ihren Braltus® Inhalator nicht nochmals an, ohne vorher Ihren Arzt aufzusuchen oder zumindest mit ihm Rücksprache gehalten zu haben. Wenn Sie eine keuchende Atmung oder Atemnot haben, sollten Sie sofort Ihren schnell wirksamen Inhalator für Akutbeschwerden (Notfallinhalator) anwenden.
Bei Patienten, die dieses Arzneimittel anwendeten, traten auch andere Nebenwirkungen auf, die nachstehend gemäß ihrer Häufigkeit aufgeführt sind.
Häufig (kann bis zu 1 von 10 Behandelten betreffen)
- Trockener Mund: Dies tritt normalerweise in leichter Form auf
Gelegentlich (kann bis zu 1 von 100 Behandelten betreffen)
- Schwindel
- Kopfschmerzen
- Geschmacksstörungen
- Verschwommenes Sehen
- Unregelmäßiger Herzschlag (Vorhofflimmern)
- Entzündung des Rachens (Pharyngitis)
- Beeinträchtigung der Stimme (Dysphonie)
- Husten
- Sodbrennen (gastroösophageale Refluxkrankheit)
- Verstopfung
- Pilzinfektion im Mund- und Rachenbereich (oropharyngeale Candidose)
- Hautausschlag
- Schwierigkeiten beim Wasserlassen (Harnverhalt)
- Schmerzen beim Wasserlassen (Dysurie)
Selten (kann bis zu 1 von 1.000 Behandelten betreffen)
- Schlaflosigkeit (Insomnie)
- Augenhalos (Lichthöfe mit Farbringen um Lichtquellen) oder unwirkliches Farbsehen in Verbindung mit geröteten Augen (Glaukom)
- Erhöhter Augeninnendruck
- Unregelmäßiger Herzschlag (supraventrikuläre Tachykardie)
- Beschleunigter Herzschlag (Tachykardie)
- Herzklopfen (Palpitation)
- Engegefühl in der Brust in Verbindung mit Husten, keuchender Atmung (Giemen) oder Atemnot unmittelbar nach Inhalation (Bronchospasmus)
- Nasenbluten (Epistaxis)
- Kehlkopfentzündung (Laryngitis)
- Entzündung der Nasennebenhöhlen (Sinusitis)
- Darmverschluss oder Darmlähmung (intestinale Obstruktion einschließlich paralytischer Ileus)
- Entzündung des Zahnfleisches (Gingivitis)
- Entzündung der Zunge (Glossitis)
- Schluckbeschwerden (Dysphagie)
- Entzündung der Mundschleimhaut (Stomatitis)
- Übelkeit
- Nesselsucht (Urtikaria)
- Juckreiz (Pruritus)
- Harnwegsinfektionen
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
- Abnahme des Körperwassers (Dehydrierung)
- Zahnverfall (Karies)
- Infektionen oder Geschwürbildungen der Haut
- Trockenheit der Haut
- Gelenkschwellung
Meldung von Nebenwirkungen
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt, Apotheker oder das medizinische Fachpersonal. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Sie können Nebenwirkungen auch direkt dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzeigen. Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden.
Bewahren Sie dieses Arzneimittel für Kinder unzugänglich auf.
Sie dürfen dieses Arzneimittel nach dem auf dem Umkarton und dem Etikett der Flasche nach „Verwendbar bis“ angegebenen Verfalldatum nicht mehr verwenden. Das Verfalldatum bezieht sich auf den letzten Tag des angegebenen Monats.
Die Flasche fest verschlossen halten.
In der Originalverpackung aufbewahren, um den Inhalt vor Feuchtigkeit zu schützen.
Nicht im Kühlschrank lagern oder einfrieren.
Haltbarkeit nach Anbruch: 30 Tage (Flasche zu 15 Kapseln) oder 60 Tage (Flasche zu 30 Kapseln).
Der Zonda®-Inhalator darf nur mit der beiliegenden Flasche mit Kapseln verwendet werden. Die Flasche befindet sich in einer Packung zusammen mit dem Inhalator oder in einer Bündelpackung bestehend aus einer Packung mit der Flasche und einer separaten Packung mit dem Inhalator. Verwenden Sie den Inhalator nicht wieder für die nächste Flasche mit Kapseln.
Entsorgen Sie Arzneimittel nicht im Abwasser. Fragen Sie Ihren Apotheker, wie das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr verwenden. Sie tragen damit zum Schutz der Umwelt bei.
Der Inhalator ist entsprechend den nationalen Anforderungen zu entsorgen.
Was Braltus® enthält
- Der Wirkstoff ist Tiotropium.
Jede Kapsel enthält 13 Mikrogramm Tiotropium (als Tiotropiumbromid).
Davon werden 10 Mikrogramm Tiotropium aus jeder Hartkapsel bei der Inhalation über das Mundstück des Zonda®-Inhalators abgegeben und in die Lungen inhaliert.
- Die sonstigen Bestandteile sind: Lactose-Monohydrat (Kapselinhalt) und Hypromellose (Kapselhülle).
Wie Braltus® aussieht und Inhalt der Packung
Braltus® 10 Mikrogramm Hartkapseln mit Pulver zur Inhalation ist eine farblose und durchsichtige Hartkapsel, die ein weißes Pulver enthält.
Dieses Arzneimittel ist in Flaschen mit Schraubdeckel erhältlich. Die Flasche wird in einem Umkarton mit einem Zonda®-Inhalator bereitgestellt. Der Zonda®-Inhalator besteht aus einem grünen Gehäuse mit Schutzkappe mit einem weißen Druckknopf.
Braltus® ist in Packungen mit 15 oder 30 Kapseln und einem Zonda®-Inhalator sowie in Bündelpackungen entweder mit 60 Kapseln (2 Packungen zu 30) und 2 Zonda®-Inhalatoren oder mit 90 Kapseln (3 Packungen zu 30) und 3 Zonda®-Inhalatoren erhältlich. Weiterhin ist Braltus® in einer Bündelpackung bestehend aus einer Packung mit 30 Kapseln (Flasche) und einer separaten Packung mit einem Zonda®-Inhalator erhältlich.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Pharmazeutischer Unternehmer
TEVA GmbH
Graf-Arco-Str. 3
89079 Ulm
Mitvertrieb
ratiopharm GmbH
Graf-Arco-Str. 3
89079 Ulm
Hersteller
Laboratorios Liconsa S.A.
Gran Via Carlos III, 98, 7 planta
08028 Barcelona
Spanien
oder
Teva Pharma B.V.
Swensweg 5, 2031 GA Haarlem
Niederlande
oder
Teva Operations Poland Sp. z o.o.
UL. Emilii Plater 53
00-113 Warszawa
Polen
oder
Actavis Ltd
BLB015, BLB016, Bulebel Industrial Estate
Zejtun, ZTN3000
Malta
Dieses Arzneimittel ist in den Mitgliedsstaaten des Europäischen Wirtschaftsraumes (EWR) unter den folgenden Bezeichnungen zugelassen:
| Belgien: | Braltus 10 micrograms Inhalatiepoeder in harde capsule/ Poudre pour inhalation en gélule/ Hartkapsel mit Pulver zur Inhalation |
| Bulgarien: | Braltus 10 микрограма на доставена доза прах за инхалация, твърда капсула |
| Dänemark: | Braltus |
| Deutschland: | Braltus 10 Mikrogramm Hartkapseln mit Pulver zur Inhalation |
| Estland: | Braltus |
| Finnland: | Braltus 10 mikrog / vapautunut annos inhalaatiojauhe, kapseli, kova |
| Griechenland: | Braltus 10 μικρογραμμάρια ανά χορηγούμενη δόση, κόνις για εισπνοή, καψάκιο, σκληρό |
| Irland: | Braltus 10 microgram per delivered dose inhalation powder, hard capsule |
| Italien: | Tiotropio Teva Italia 10 microgrammi per dose erogata polvere per inalazione, capsula rigida |
| Kroatien: | Braltus 10 mikrograma po primijenjenoj dozi prašak inhalata, tvrde kapsule |
| Lettland: | Braltus 10 mikrogrami saņemtajā devā, inhalācijas pulveris cietās kapsulās |
| Litauen: | Braltus 10 mikrogramų/dozėje įkvepiamieji milteliai (kietoji kapsulė) |
| Luxemburg: | Braltus 10 Mikrogramm pro abgegebener Dosis Kapsel mit Inhalationspulver |
| Niederlande: | Braltus 10 microgram per afgegeven dosis inhalatiepoeder in harde capsules |
| Norwegen: | Braltus |
| Österreich: | Braltus 10 Mikrogramm pro abgegebener Dosis Kapseln mit Inhalationspulver |
| Polen: | Braltus |
| Portugal: | Braltus |
| Rumänien: | Braltus 10 micrograme per doză eliberată capsule cu pulbere de inhalat |
| Schweden: | Braltus |
| Slowakei: | Braltus 10 mikrogramov |
| Slowenien: | Braltus 10 mikrogramov na dovedeni odmerek, prašek za inhaliranje, trde kapsule |
| Spanien: | Braltus 10 microgramos/dosis liberada polvo para inhalación |
| Tschechische Republik: | Braltus 10 mikrogramů/dávka, prášek k inhalaci ve tvrdých tobolkách |
| Ungarn: | Braltus 10 mikrogramm adagolt inhalációs por kemény kapszulában |
| Vereinigtes Königreich (Nordirland): | Braltus 10 microgram per delivered dose inhalation powder, hard capsule |
| Zypern: | Braltus 10 μικρογραμμάρια ανά χορηγούμενη δόση, κόνις για εισπνοή, καψάκιο, σκληρό |
Diese Packungsbeilage wurde zuletzt überarbeitet im März 2023.
Versionscode: Z08
Gebrauchsanweisung für den Zonda®-Inhalator
Liebe Patientin, lieber Patient,
Der Zonda®-Inhalator ermöglicht Ihnen das Inhalieren des in der Braltus® Kapsel enthaltenen Arzneimittels, das Ihnen Ihr Arzt für Ihre Atemwegsprobleme verordnet hat.
Bitte folgen Sie den Anweisungen Ihres Arztes zur Anwendung von Braltus® sehr sorgfältig. Der Zonda®-Inhalator wurde speziell für Braltus® Kapseln entwickelt: Sie dürfen ihn nicht zur Anwendung von anderen Arzneimitteln verwenden. Die Kapseln dürfen nur mit dem Zonda®-Inhalator inhaliert werden. Verwenden Sie keinen anderen Inhalator zur Anwendung von Braltus® Kapseln. Jede Kapsel enthält nur eine kleine Menge Pulver. Sie dürfen die Kapsel nicht öffnen, da sie sonst nicht mehr funktioniert.
Der Zonda®-Inhalator darf nur mit der beigepackten Flasche mit Kapseln verwendet werden. Die Flasche befindet sich in einer Packung zusammen mit dem Inhalator oder in einer Bündelpackung bestehend aus einer Packung mit der Flasche und einer separaten Packung mit dem Inhalator. Verwenden Sie den Inhalator nicht wieder für die nächste Flasche mit Kapseln. Entsorgen Sie den Zonda®-Inhalator nach 15 Anwendungen (bei Flaschen mit 15 Kapseln) oder 30 Anwendungen (bei Flaschen mit 30 Kapseln).
Zonda®
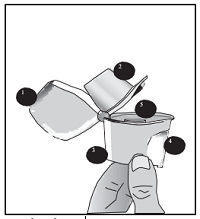 |
1. Schutzkappe |
| 1. Öffnen Sie die Schutzkappe durch Hochziehen. |
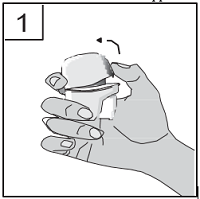 |
| 2. Halten Sie das Geräteunterteil des Inhalators fest und öffnen Sie dann das Mundstück durch Hochziehen in Pfeilrichtung. |
 |
| 3. Entnehmen Sie eine Braltus® Kapsel unmittelbar vor der Anwendung aus der Flasche und verschließen Sie anschließend die Flasche sorgfältig. Legen Sie die Kapsel in das kapselförmige Abteil im Geräteunterteil des Inhalators. Bewahren Sie die Kapsel nicht im Zonda®-Inhalator auf. |
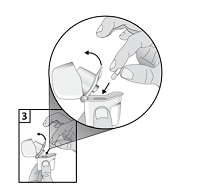 |
| 4. Legen Sie Kapseln nicht direkt in das Mundstück. |
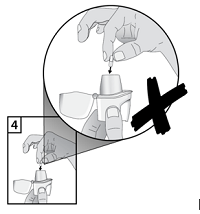 |
| 5. Klappen Sie das Mundstück zu, bis Sie einen Klick hören. Lassen Sie dabei die Schutzkappe offen. |
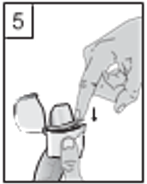 |
| 6. Halten Sie den Inhalator mit dem Mundstück nach oben. Drücken Sie den Anstechknopf nur einmal fest bis zum Anschlag ein. Lassen Sie den Anstechknopf danach wieder los. Die Kapsel wird damit angestochen und das Arzneimittel ist für die Inhalation verfügbar. |
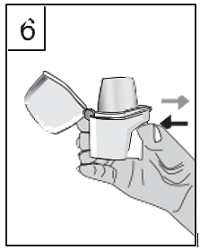 |
| 7. Atmen Sie vollständig aus. Es ist wichtig, sich dabei vom Mundstück abzuwenden. Atmen Sie keinesfalls in das Mundstück hinein. |
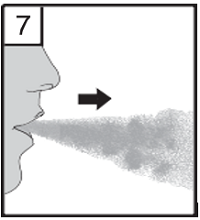 |
| 8. Nehmen Sie das Mundstück in den Mund und halten Sie den Kopf aufrecht. Umschließen Sie das Mundstück mit den Lippen und atmen Sie langsam und tief genug ein, bis Sie hören oder fühlen, dass die Kapsel im Inhalator vibriert. Halten Sie Ihren Atem so lange wie möglich an, ohne dass es unangenehm wird, während Sie den Inhalator absetzen. Atmen Sie nun normal weiter. Wiederholen Sie Schritt 7 und 8, um die Kapsel vollständig zu entleeren. |
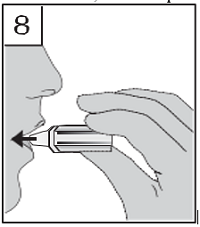 |
| 9. Öffnen Sie nach der Anwendung erneut das Mundstück und kippen Sie die leere Kapsel aus dem Inhalator. Verschließen Sie Mundstück und Schutzkappe wieder und bewahren Sie Ihren Zonda®-Inhalator auf. |
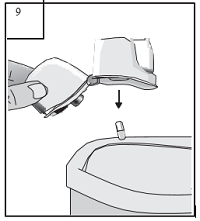 |
Der Zonda®-Inhalator ist ein Medizinprodukt.

0051
Hersteller
Laboratorios LICONSA S.A.
Avda. Miralcampo, No 7, Polígono Industrial Miralcampo
19200 Azuqueca de Henares, Guadalajara
Spanien
1) Durchschnittliche Kundenbewertung (gerundet) zum Stichtag 20.02.2025 auf den Websites der genannten Online-Apotheken. Die einzelnen Nutzerbewertungen wurden inhaltlich nicht überprüft. Es kann von ratiopharm außerdem nicht sichergestellt werden, dass die veröffentlichten Bewertungen von solchen Verbrauchern stammen, die die Waren tatsächlich genutzt oder erworben haben.
